1,000 г/см3 (3,98шC), tпл 0шC, tкип 100шC; при замерзании образует лед. Одно из наиболее распространенных соединений в природе (количество воды на поверхности Земли 1,39?1018 т, в атмосфере 1,3?1013 т); известны изотопные разновидности (смотри Тяжелая вода). Вода входит в состав многих минералов и горных пород, всех живых организмов (45 - 98%, в том числе в организме человека около 60% массы тела), присутствует в почве. Обязательный компонент практически всех технологических процессов в промышленности и сельском хозяйстве. Вода особой чистоты необходима в производстве продуктов питания, полупроводников, люминофоров, в ядерной технике, химическом анализе и др. Как лечебные применяют природные воды, содержащие повышенное количество минеральных солей, газы, некоторые химические элементы (смотри Минеральные воды).
Современная энциклопедия . 2000 .
Смотреть что такое "ВОДА, H2O" в других словарях:
Вода - получить на Академике рабочий купон на скидку Технопарк или выгодно вода купить с бесплатной доставкой на распродаже в Технопарк
H2O: Just Add Water … Википедия
Вода - ВОДА, H2O, жидкость без запаха, вкуса и цвета; плотность 1,000 г/см3 (3,98°C), tпл 0°C, tкип 100°C; при замерзании образует лед. Одно из наиболее распространенных соединений в природе (количество воды на поверхности Земли 1,39´1018 т, в атмосфере … Иллюстрированный энциклопедический словарь
вода - вода, H2O, жидкость без запаха, вкуса, цвета (в толстых слоях голубоватая). Простейшее устойчивое соединение водорода с кислородом (11,19% Н и 88,81% О по массе). Плотность 1000 г/см3 (3,98ºC), tпл 0ºС, tкип 100ºC. Самое распространённое вещество … Сельское хозяйство. Большой энциклопедический словарь
Содержание 1 Эпизоды 2 Обзор сезонов 3 Список серий 3.1 … Википедия
Хим. соединение водорода и кислорода. Весовой состав ее: 11,19% Н и 88,81% О. Молекулярная масса 18,0153. В молекуле В. имеется 10 электронов (5 пар): одна пара внутренних электронов расположена вблизи ядра кислорода, две пары внешних электронов… … Геологическая энциклопедия
ВОДА - вода, окись водорода, H2O, простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом (11,19% Н и 88,81% О по массе). Молекулярная масса 18,0160, t замерзания 0°C (при 1 ат), t кипения 100ºC (при 1 ат), плотность при… … Ветеринарный энциклопедический словарь
вода (вещество) - — EN water (substance) Common liquid (H2O) which forms rain, rivers, the sea, etc., and which makes up a large part of the bodies of organisms. (Source: PHC)… … Справочник технического переводчика
вода адсорбційна - вода адсорбционная adsorbtion water Adsorptionswasser молекули H2O, які притягаються мінералами під впливом поверхневої енергії … Гірничий енциклопедичний словник
ВОДА - H2O, жидкость без запаха, вкуса, цвета (в толстых слоях голубоватая). Простейшее устойчивое соединение водорода с кислородом (11,19% Н и 88,81% О по массе). Плота. 1000 г/см3 (3,98 °С), tпл 0 °С, tкип 100 °С. Самое распространённое в во в природе … Сельско-хозяйственный энциклопедический словарь
Окись водорода, H20, простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом (11,19% водорода и 88,81% кислорода по массе), молекулярная масса 18,0160; бесцветная жидкость без запаха и вкуса (в толстых слоях… … Большая советская энциклопедия
Другие названия: оксид водорода, дигидрогена монооксид.
Вода - неорганическое соединение с химической формулой H 2 O.
Физические свойства
Химические свойства и методы получения
Вода наивысшей чистоты
Применяемая в лабораториях дистиллированная вода обыкновенно содержит еще заметные количества растворенного диоксида углерода , а также следы аммиака , органических оснований и других органических веществ. Получение очень чистой воды осуществляют в несколько этапов. Сначала в воду на каждый 1 л добавляют 3 г NaOH (ч. д. а.) и 0,5 г KMnO 4 и производят перегонку в аппаратуре на шлифах, изготовленной из стекла типа дюран 50 или солидекс, причем собирают только среднюю фракцию. Таким путем удаляется растворенный диоксид углерода и происходит окисление органических веществ. Удаление аммиака достигается при проведении второй и третьей перегонки с добавлением 3 г KHSO 4 или 5 мл 20%-ной H 3 PO 4 , причем эти реагенты предварительно нагревают с небольшим количеством KMnO 4 . Чтобы предотвратить «выползание» добавленного электролита в конденсат, при проведении третьей перегонки создают «сухой участок», для чего отрезок трубки между насадкой на колбу и холодильником нагревают до 150 °C. Последнюю перегонку, служащую для освобождения от следов электролитов, проводят из кварцевой колбы с холодильником из кварца. Верхнюю трубку холодильника, согнутую под прямым углом, вставляют без всякого уплотняющего материала непосредственно в сужение колбы (рис. 1). Во избежание попадания брызг воды целесообразно на пути пара поместить брызгоулавливатель. В качестве приемника служат колбы из кварца, платины, стекла типа дюран 50 или солидекс, которые предварительно обрабатывают водяным паром. Полученная таким способом вода является «чистой по значению рН» (т.е. со значением pH, равным 7,00).Рис. 1. Способы присоединения колбы к холодильнику при перегонке воды особой чистоты.
а - простое (дешевое) исполнение;
б - с брызгоулавливателем.
Чистоту воды определяют путем измерения ее электропроводности, которая непосредственно после перегонки воды должна составлять менее 10 -6 Ом -1 ·см -1 . Испытание на содержание в воде диоксида углерода производят при помощи баритовой воды, а пробу на содержание аммиака - реактивом Несслера . Очень чистую воду хранят в кварцевых или платиновых сосудах. Можно использовать для этого также и колбы из стекла дюран 50 или солидекс, предварительно обработанные паром в течение долгого времени и предназначенные исключительно для этой цели. Такие сосуды лучше всего закрывать пришлифованными колпачками.
Вода, предназначенная для измерения электропроводности
Способ 1. Получение путем перегонки. Необходимую для проведения измерений электропроводности воду наивысшей степени чистоты получают путем особенно тщательной перегонки уже предварительно очень хорошо очищенной воды. Последняя должна при 25°С обладать электропроводностью (χ ), равной 1·10 -6 -2·10 -6 Ом -1 ·см -1 . Ее получают указанным выше методом или же путем двукратной перегонки: а) со смесью перманганата калия и серной кислоты и б) с гидроксидом бария . Для перегонки пользуются колбой из стекла типа дюран 50 или солидекс с присоединенным к ней медным или кварцевым холодильником.
Рис. 2. Конструкция прибора для перегонки воды, предназначенной для измерения электропроводности.
1 - нагревательная обмотка (60 Ом); 2 - колбонагреватель (130 Ом); 3 - переходник на шлифах .
Все части прибора для одноступенчатой перегонки по методу Кортюма (рис. 2) изготовлены из стекла типа дюран 50 или солидекс, за исключением короткого кварцевого холодильника, присоединенного к перегонному прибору на нормальном шлифе. Ведущую к холодильнику согнутую часть нагревают при помощи нагревательного элемента (60 Ом) до температура превышающей 100°С, во избежание увлечения жидкой воды в холодильник. Расположенный ниже обратный холодильник высотой 60 см снабжен спиралью Видмера. К запасной склянке холодильник присоединяется переходными шлифами. Чтобы дистиллат сохранил малую электропроводность в течение долгого времени, переходные шлифы и запасную склянку предварительно необходимо в течение нескольких суток обработать горячей разбавленной кислотой. Воду высокой чистоты (χ =(1-2)·10 -6 Ом -1 ·см -1) перегоняют, пропуская через прибор медленный поток сжатого воздуха из стального баллона со скоростью приблизительно 1 пузырек в секунду. Воздух предварительно очищают, пропуская его через семь промывных склянок, из которых одна наполнена концентрированной серной кислотой , три содержат 50%-ный раствор гидроксида калия и три - «воду для измерения электропроводности» (последние три промывалки должны быть снабжены пористыми стеклянными пластинками). Полученную воду отбирают из запасной склянки путем вытеснения ее очищенным, как указано выше, сжатым воздухом. Нагревание воды в колбе производят при помощи колбонагревателя мощностью 300 Вт. Колбу можно легко наполнить водой или опорожнить при помощи расположенной в середине ее вертикальной трубки. Заполнение колбы проще всего осуществить, прекратив пропускание воздуха и выключив колбонагреватель.
К трехходовому крану в конце холодильника присоединяют сосуд, в котором проводят измерение электропроводности перегнанной воды до тех пор, пока не будет достигнуто желаемое значение χ . После этого воду путем переключения крана направляют в запасной сборник.
Таким путем за 1 ч можно получить 100 мл воды, для которой при 25 °С χ=2·10 -7 Ом -1 ·см -1 . Если перегонку вести очень медленно, то электропроводность полученной воды может достигать значения χ=10 -8 Ом -1 ·см -1 .
Способ 2. Получение путем ионного обмена.
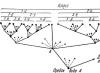
В больших количествах «воду для измерения электропроводности» (х от 7·10 -8 до 1,5·10 -7 Ом -1 ·см -1 можно получить путем ионного обмена в аппаратуре, схематически показанной на рис. 3.

Рис. 3. Конструкция установки для: получения воды особой чистоты путем ионного обмена.
1 - ионообменная колонна;
2 - пористый стеклянный фильтр;
3 - ячейка для измерения электропроводности;
4 - сборник;
6 - трубка для поглощения диоксида углерода.
Колонку из стекла пирекс (длиной 75 см и диаметром 7,5 см) с пористой стеклянной пластинкой на дне наполняют смесью (750 г), состоящей из одной части амберлита IR 120 (16-50 меш) и двух частей амберлита IRA 400 (20-50 меш). Смолу в колонне накрывают перфорированным полиэтиленовым кружком, плавающим в растворе и служащим для предотвращения взмучивания смолы потоком воды. Через колонну пропускают обычную дистиллированную воду. Как только электропроводность воды, измеряемая в ячейке 3, достигнет достаточно низкого значения, сначала промывают, а за тем наполняют ею сосуд 4. Попадание в воду диоксида углерода нз воздуха предотвращают при помощи двух вставленных в колонну и в приемник хлоркальциевых трубок 5, заполненных гранулированным «карбосорбом» с индикатором.
Предварительную обработку смолы и се регенерацию производят следующим образом. Катионообменник IR 120 несколько раз промывают дистиллированной водой, удаляя мелкие частицы декантацией. Затем на стеклянном пористом фильтре смолу дважды обрабатывают попеременно 1 н. NaOH и 2 н. HCl , промывая после каждой обработки дистиллированной водой до нейтральной реакции. Анионообменник IRA 400 сначала также промывают дистиллированной водой. После декантации смолу на стеклянном пористом фильтре обрабатывают 2 н. NaOH, не содержащим карбонатов (воду для приготовления раствора освобождают от диоксида углерода перегонкой). Обработку ведут до тех пор, пока концентрация ионов хлора в элюате не понизится до минимума. После этого смолу промывают дистиллированной водой до достижения нейтральной реакции в промывных водах.
Перед регенерацией смолы смесь разделяют. В стакан вносят смолу, суспендируют ее в этаноле и добавляют хлороформ, причем аннионообменник собирается в верхнем слое. Смесь разделяют на составные части и проводят раздельную регенерацию.
При пропускании через аппаратуру обычной дистиллированной воды можно без регенерации получить со скоростью 1 л/мин 7000 л «воды для измерения электропроводности» с х=5,52·10 -8 Ом -1 ·см -1 при 25 °С.
Список использованной литературы
- Волков, А.И., Жарский, И.М. Большой химический справочник / А.И. Волков, И.М. Жарский. - Мн.: Современная школа, 2005. - 608 с ISBN 985-6751-04-7.
- M. Баудлер , Г. Брауэр, Ф. Губер, В. Квасник, П.В. Шенк, М. Шмайсер, Р. Штойдель. Руководство по неорганическому синтезу: В 6-ти томах. Т.1. Пер. с. нем./Под ред. Г. Брауэра. - М.: Мир, 1985. - 320 с., ил. [с. 152-156]
Из оксидов водорода самым распространенным на Земле является вода. Эмпирическая формула – Н2О. Молекулярная масса – 18. Строение молекулы воды (структурная формула):
Молекулы воды имеют треугольную формулу: атомы водорода образуют с атомом кислорода угол, равный 104,3 %. Вблизи атома кислорода образуется отрицательно заряженное поле, т. к. наибольшая электронная плотность сосредотачивается на атоме кислорода, а вблизи атомов водорода образуется положительно заряженное поле – молекула воды – диполь. Вследствие полярности молекулы воды ассоциируют, образуя водородные связи. Последние обуславливают все физические свойства воды.
Физические свойства: вода – бесцветная жидкость, без вкуса и запаха, плотность – 1 г/см3; температура замерзания – 0 °C (лед), кипения – 100 °C (пар). При 100 °C и нормальном давлении водородные связи рвутся и вода переходит в газообразное состояние – пар. У воды плохая тепло-и электропроводность, но хорошая растворимость.
Химические свойства: вода незначительно диссоциирует:
В присутствии воды идет гидролиз солей – разложение их водой с образованием слабого электролита:
Взаимодействует со многими основными оксидами, металлами:

С кислотными оксидами:

Получение: вода образуется при горении водорода в кислороде: 2Н2 + О2 = 2Н2О
Эта реакция протекает мгновенно при 700 °C. Смесь двух объемов водорода и одного объема кислорода называется гремучей смесью . Методом перегонки получают чистую воду – дистиллированную воду.
Нахождение в природе: вода составляет 2/3 поверхности Земли. Природная вода не бывает чистой, т. к. в ней растворено огромное количество солей. Вода входит в состав многих кристаллогидратов: Nа2СО3 ? 10Н2О ; CuSO4 ? 5Н2О ; MgSO4? 7Н2О . Тяжелая вода D2О отличается от обычной, образованной водородом – протием – наличием в ней второго изотопа водорода – D (дейтерия), Аr которого – 2, следовательно, молекулярная масса тяжелой воды – 20. Плотность D2О = 1,1050 г/см3; температура кипения – 101,4 °C, замерзания – 3,8 °C. Химически менее активна. Применяется в качестве замедлителя нейтронов в ядерных реакторах. Она непригодна для жизненных процессов, т. к. изменяет скорость биохимических реакций. В обычной воде частично содержится тяжелая вода.
Размышления (не учебный материал!!!) на тему
свойств молекулы воды
Самое распространенное вещество на нашей планете. Без нее не было бы жизни. Все живые структуры, за исключением вирусов, по большей части состоят из воды. На ее примере детям в школе объясняют строение молекул, химические формулы. Свойства, характерные только для воды, используются в живой природе, а так же в хозяйственной жизни человека.
С детства нам знакомое вещество, никогда не вызывавшее каких-то вопросов. Ну вода, и что? А в таком простом, казалось бы, веществе скрыто много загадок.
Вода - основной природный растворитель. Все реакции в живых организмах так или иначе протекают в водной среде, вещества реагируют в растворенном состоянии.
У воды отличная теплоемкость, но довольно малая теплопроводность. Это позволяет использовать воду как транспорт тепла. На этом принципе основан механизм охлаждения многих организмов. А в атомной энергетике и воду, благодаря этому свойству, используют в качестве теплоносителя.
В воде не только протекают реакции, она сама вступает в реакции. Гидратация, фотолиз и т. д.
Это только некоторые свойства, ни одно вещество не может похвастаться таким наборов свойств. Поистине это вещество уникально.
Ну а теперь ближе к теме.
Всегда, везде, даже в школе на уроках химии ее называют просто «вода».
А вот какое химическое называние и свойства молекулы воды ?
На просторах интернета и учебной литературы можно встретить такие называния: оксид водорода, гидроксид водорода, гидроксильная кислота. Это самые наиболее часто встречающиеся.
Так к какому все таки классу неорганических веществ относится вода?
Давайте разберемся в этом вопросе.
Ниже приведена схема:
Эта версия более правдоподобна: гидроксильная группа явно намекает на что-то подобное. Но какой гидроксид? Давайте опять разберем по свойствам гидроксиды:
Свойства основных гидроксидов (оснований):
Для растворимых оснований (щелочей):
Для растворимых оснований (щелочей) характерны реакции ионного обмена.
Взаимодействие растворимых оснований (щелочей) с кислотными основаниями.
Взаимодействие с амфотерными гидроксидами.
Нерастворимые основания разлагаются при нагревании.
Молекула воды не проявляет ни одного свойства, только разве что, при сильном нагревании, она подвергнется разложению, ну а это со всеми веществами так — есть определенный порог температуры, выше которого связи не могут больше существовать и разрушаются.
Так же аргумент, «против» амфотерного и основного гидроксида — основные и амфотерные гидроксиды образуют только металлы.
Теперь подходим к самой интересной части. Выходит, что вода - это
кислотный гидроксид , то есть кислородосодержащая кислота .
Рассмотрим по свойствам.
Для кислотных гидроксидов характерны:
Реакции с металлами.
Реакции с основными и амфотерными оксидами.
Реакции с основаниями и амфотерными гидроксидам.
Реакции с солями.
Для сильных кислот так же реакции ионного обмена.
Вытеснение более слабых, а так же летучих кислот из солей.
Для молекулы воды характерны почти все эти свойства.
Разберем подробно.
- Реакции с металлами. Не все металлы способны реагировать с водой. Вода как кислота — очень слабая, но, тем не менее, это свойство она проявляет:
HOH + Na → NaOH + H 2 - из воды вытесняется водород — вода ведет себя, как большинство кислот.
- Реакции с основными и амфотерными оксидами. С амфотерными оксидами не реагирует, так как кислотные свойства слабые, но реагирует с основными оксидами (не со всеми правда, это объясняется слабыми кислотными свойствами):
HOH + Na 2 O → 2NaOH
- Реакции с основаниями и амфотерными гидроксидам. Тут вода не может похвастаться такими реакциями — из-за своей слабости как кислоты.
- Реакции с солями. Некоторые соли подвергаются гидролизу - как раз таки реакции с водой.
Эта реакция так же иллюстрирует последнее свойство - вытеснение кислоты, у воды получается вытеснить сероводород.
Из определения: «кислота - это сложное вещество, состоящее из водорода и кислотного остатка, при диссоциирующее на катион H + и катион кислотного остатка «.
Все подходит. И получается, что кислотный остаток - это гидроксильная группа OH.
И, как я и говорил раньше, вода образует соли, выходит, что соли воды-кислоты - это основные и амфотерные гидроксиды: металл, соединенный с кислотным остатком (OH).
И схемы реакций:
кислота + металл → соль + водород (в общем случае)
HOH + Na → NaOH + H 2
кислота + основный оксид → соль вода
HOH + Na 2 O → 2NaOH (соль образуется, только воды не образуется, да и с чего бы это вдруг в результате реакции с водой, должна образовываться вода)
соль + кислота → другая кислота + другая соль
Al 2 S 3 + HOH → Al(OH) 3 ↓ + H 2 S
Итак, мы пришли к выводу, что амфотерные и основные гидроксиды - это соли воды — кислоты.
Тогда как их называть?
Весть термин «гидроксид» также применим к кислородосодержащим кислотам. По правилам получается:
название иона + ат = Гидрокс + ат.
Соли воды - гидроксаты.
Вода настолько слабая кислота, что проявляет некоторые амфотерные свойства, например реакции с кислотными оксидами.
И в воде нейтральная среда, а не кислая, как во всех кислотах - это исключение из правила.
Но в конце концов, как говорил замечательный русский химик-органик «Неосуществимых реакций нет, а если реакция не идет, то еще не найден катализатор».
Подведем итог.
Сформулируем основные положения теории «Вода - кислота» :
Молекула воды по свойствам — слабая (очень слабая) кислота.
Вода настолько слабая, что проявляет амфотерные свойства и у нее нейтральная реакция среды.
Вода как кислота образует соли - гидроксаты.
К гидроксатам относятся амфотерные и основные гидроксиды.
Формула воды: HOH.
Правильные названия воды: гидроксид водорода, гидроксильная кислота.
Общеизвестна формула основы жизни - воды. Её молекула состоит из двух атомов водорода и одного кислорода, что записывается как H2O. Если же кислорода будет в два раза больше, то получится совсем другое вещество - H2O2. Что это и чем полученное вещество будет отличаться от своей «родственницы» воды?
H2O2 - что это за вещество?
Остановимся на нем подробнее. H2O2 - формула перекиси водорода, Да, той самой, которой обрабатывают царапины, белой. Пероксид водорода H2O2 - научное.
Для дезинфекции используют трехпроцентный раствор перекиси. В чистом или концентрированном виде она вызывает химические ожоги кожи. Тридцатипроцентный раствор перекиси иначе называют пергидроль; раньше его применяли в парикмахерских для обесцвечивания волос. Обожженная им кожа также становится белой.
Химические свойства Н2О2
Перекись водорода представляет собой жидкость без цвета и с «металлическим» привкусом. Является хорошим растворителем и сама легко растворяется в воде, эфире, спиртах.
Трёх- и шестипроцентные растворы перекиси обычно готовят, разбавляя тридцатипроцентный раствор. При хранении концентрированного Н2О2 происходит разложение вещества с выделением кислорода, поэтому в плотно закупоренных емкостях его хранить не следует во избежание взрыва. С уменьшением концентрации пероксида, повышается его устойчивость. Также для замедления разложения Н2О2 можно добавлять в него различные вещества, например, фосфорную или салициловую кислоту. Для хранения растворов сильной концентрации (более 90 процентов) в перекись добавляют пирофосфат натрия, который стабилизирует состояние вещества, а также используют сосуды из алюминия.

Н2О2 в химических реакциях может быть как окислителем, так и восстановителем. Однако чаще пероксид проявляет окислительные свойства. Перекись принято считать кислотой, но очень слабой; соли перекиси водорода называют пероксидами.
как метод получения кислорода
Реакция разложения Н2О2 происходит при воздействии на вещество высокой температуры (более 150 градусов Цельсия). В результате образуются вода и кислород.
Формула реакции - 2 Н2О2 + t -> 2 Н2О + О2
Степень окисления Н в Н 2 О 2 и Н 2 О = +1.
Степень окисления О: в Н 2 О 2 = -1, в Н 2 О = -2, в О 2 = 0
2 О -1 - 2е -> О2 0
О -1 + е -> О -2
2 Н2О2 = 2 Н2О + О2
Разложение перекиси водорода может произойти и при комнатной температуре, если использовать катализатор (химическое вещество, ускоряющее реакцию).
В лабораториях одним из методов получения кислорода, наряду с разложением бертолетовой соли или марганцовки, является реакция разложения перекиси. В таком случае в качестве катализатора используют оксид марганца (IV). Другие вещества, ускоряющие разложение H2O2, - медь, платина, гидроксид натрия.
История открытия перекиси
Первые шаги к открытию перекиси были сделаны в 1790 году немцем Александром Гумбольдтом, когда он обнаружил превращения оксида бария в пероксид при нагревании. Тот процесс сопровождался поглощением кислорода из воздуха. Через двенадцать лет учеными Тенаром и Гей-Люссаком был проведен опыт по сжиганию щелочных металлов с избытком кислорода, в результате чего был получен пероксид натрия. Но пероксид водорода был получен позже, лишь в 1818 году, когда Луи Тенар изучал воздействие кислот на металлы; для их устойчивого взаимодействия было необходимо низкое количество кислорода. Проводя подтверждающий опыт с перекисью бария и серной кислотой, ученый добавил к ним воду, хлористый водород и лёд. Через непродолжительное время, Тенар обнаружил на стенках емкости с пероксидом бария небольшие застывшие капли. Стало ясно, что это H2O2. Тогда дали полученному H2O2 название «окисленная вода». Это и была перекись водорода - бесцветная, ничем не пахнущая, трудноиспаримая жидкость, хорошо растворяющая другие вещества. Результат взаимодействия H2O2 и H2O2 - реакция диссоциации, перекись растворима в воде.

Интересный факт - быстро обнаружились свойства нового вещества, позволяющие использовать его в реставрационных работах. Сам Тенар при помощи пероксида отреставрировал картину Рафаэля, потемневшую от времени.
Перекись водорода в XX веке
После тщательного изучения полученного вещества его стали производить в промышленных масштабах. В начале двадцатого века ввели электрохимическую технологию производства перекиси, основанную на процессе электролиза. Но срок годности полученного таким методом вещества был невелик, около пары недель. Чистая перекись нестабильна, и по большей части её выпускали в тридцатипроцентной концентрации для отбеливания ткани и в трёх- или шестипроцентной - для бытовых нужд.
Учёные фашистской Германии использовали пероксид для создания ракетного двигателя на жидком топливе, который использовался для оборонных нужд во Второй Мировой войне. В результате взаимодействия Н2О2 и метанола/гидразина, получалось мощное топливо, на котором самолет достигал скорости более 950 км/ч.
Где применяется Н2О2 сейчас?
- в медицине - для обработки ран;
- в целлюлозно-бумажной промышленности используются отбеливающие свойства вещества;
- в текстильной промышленности перекисью отбеливают натуральные и синтетические ткани, меха, шерсть;
- как ракетное топливо или его окислитель;
- в химии - для получения кислорода, как пенообразователь для производства пористых материалов, как катализатор или гидрирующий агент;
- для производства дезинфицирующих или чистящих средств, отбеливателей;
- для обесцвечивания волос (это устаревший метод, так как волосы сильно повреждаются пероксидом);

Перекись водорода можно успешно применять для решения разных бытовых задач. Но использовать в этих целях можно лишь трёхпроцентную перекись водорода. Вот некоторые способы:
- Для очистки поверхностей нужно залить перекись в сосуд пульверизатором и разбрызгивать на загрязненные места.
- Для дезинфекции предметов их нужно протереть неразбавленным раствором Н2О2. Это поможет очистить их от вредных микроорганизмов. Губки для мытья можно замочить в воде с перекисью (пропорция 1:1).
- Для отбеливания тканей при стирке белых вещей добавляют стакан пероксида. Можно также выполоскать белые ткани в воде, смешанной со стаканом Н2О2. Этот способ возвращает белизну, предохраняет ткани от пожелтения и помогает удалить трудновыводимые пятна.
- Для борьбы с плесенью и грибком следует смешать в емкости с пульверизатором перекись и воду в пропорции 1:2. Полученную смесь распылять на зараженные поверхности и через 10 минут очищать их при помощи щётки или губки.
- Обновить потемневшую затирку в кафельной плитке можно, распылив пероксид на нужные участки. Через 30 минут нужно тщательно потереть их жесткой щёткой.
- Для мытья посуды полстакана Н2О2 добавить в полный таз с водой (или раковину с закрытым сливом). Промытые в таком растворе чашки и тарелки будут сиять чистотой.
- Чтобы очистить зубную щётку, нужно опустить её в неразведенный трёхпроцентный раствор перекиси. Затем промыть под сильной струей воды. Этот способ хорошо дезинфицирует предмет гигиены.
- Чтобы продезинфицировать купленные овощи и фрукты, следует распылить на них раствор 1 части перекиси и 1 части воды, после чего тщательно промыть их водой (можно холодной).
- На дачном участке при помощи Н2О2 можно бороться с болезнями растений. Нужно опрыскивать их раствором перекиси или замочить семена незадолго до посадки в 4,5 литрах воды, смешанной с 30 мл сорокапроцентной перекиси водорода.
- Для оживления аквариумных рыбок, если они отравились аммиаком, задохнулись при отключении аэрации или по другой причине, можно попробовать поместить их в воду с перекисью водорода. Нужно смешать трёхпроцентную перекись с водой из расчёта 30 мл на 100 литров и поместить в полученную смесь бездыханных рыб на 15-20 минут. Если они не оживут за это время, значит, средство не помогло.

Даже в результате активного встряхивания бутылки с водой в ней образуется некоторое количество пероксида, так как вода при этом действии насыщается кислородом.
В свежих фруктах и овощах Н2О2 также содержится, пока они не подвергнутся термической обработке. При нагреве, варке, обжарке и других процессах с сопутствующей высокой температурой уничтожается большое количество кислорода. Именно поэтому прошедшие кулинарную обработку продукты считаются не такими полезными, хотя какое-то количество витаминов в них остается. Свежевыжатые соки или кислородные коктейли, подаваемые в санаториях, полезны по той же причине - из-за насыщения кислородом, который дает организму новые силы и очищает его.
Опасность перекиси при употреблении внутрь
После вышесказанного может показаться, что перекись можно специально принимать внутрь, и от этого будет польза организму. Но это совсем не так. В воде или соках соединение содержится в минимальных количествах и тесно связано с другими веществами. Прием же «ненатуральной» перекиси водорода внутрь (а вся перекись, купленная в магазине или произведенная в результате химических опытов самостоятельно, никак не может считаться натуральной, к тому же обладает слишком высокой концентрацией по сравнению с природной) может привести к опасным для жизни и здоровья последствиям. Чтобы понять - почему, нужно вновь обратиться к химии.
Как уже упомянуто, при некоторых условиях пероксид водорода разрушается и выделяет кислород, являющийся активным окислителем. может произойти при столкновении Н2О2 с пероксидазой - внутриклеточным ферментом. В основе использования перекиси для дезинфекции положены именно её окислительные свойства. Так, когда рану обрабатывают Н2О2 - выделяющийся кислород уничтожает живые патогенные микроорганизмы, попавшие в нее. Такое же действие она оказывает и на другие живые клетки. Если обработать неповрежденную кожу пероксидом, а потом протереть место обработки спиртом, почувствуется жжение, что подтверждает наличие микроскопических повреждений после перекиси. Но при внешнем применении перекиси низкой концентрации какого-то заметного вреда организму не будет.

Другое дело, если её пытаться принимать внутрь. То вещество, которое способно повреждать даже сравнительно толстую кожу снаружи, попадает на слизистые оболочки пищеварительного тракта. То есть происходят химические мини-ожоги. Разумеется, выделяющийся окислитель - кислород - может заодно убить и вредные микробы. Но этот же процесс произойдет и с клетками пищевого тракта. Если ожоги в результате действия окислителя будут повторяться, то возможна атрофия слизистых оболочек, а это - первый шаг на пути к раку. Гибель клеток кишечника приводит к невозможности организма усваивать питательные вещества, этим объясняется, например, снижение веса и исчезновение запоров у некоторых людей, практикующих «лечение» перекисью.
Отдельно нужно сказать о таком методе употребления перекиси, как внутривенные инъекции. Даже если по какой-то причине их назначил врач (оправдано это может быть лишь при заражении крови, когда других подходящих лекарств в наличии нет), то под медицинским наблюдением и со строгим расчетом дозировок риски все-таки есть. Но в такой экстремальной ситуации это будет шансом на выздоровление. Самому же назначать себе уколы перекиси водорода ни в коем случае нельзя. Н2О2 представляет большую опасность для клеток крови - эритроцитов и тромбоцитов, так как при попадании в кровеносное русло разрушает их. К тому же, может произойти смертельно опасная закупорка сосудов высвободившимся кислородом - газовая эмболия.
Меры безопасности в обращении с Н2О2
- Хранить в недоступном для детей и недееспособных лиц месте. Отсутствие запаха и выраженного вкуса делает перекись особенно опасной для них, так как могут быть приняты большие дозы. При попадании внутрь раствора, последствия употребления могут быть непредсказуемыми. Необходимо незамедлительно обратиться к врачу.
- Растворы перекиси концентрацией более трёх процентов вызывают ожоги при попадании на кожу. Место ожога нужно промыть большим количеством воды.

- Не допускать попадания раствора пероксида в глаза, так как образуется их отек, покраснение, раздражение, иногда болевые ощущения. Первая помощь до обращения к врачу - обильное промывание глаз водой.
- Хранить вещество так, чтобы было понятно, что это - H2O2, то есть в емкости с наклейкой во избежание случайного применения не по назначению.
- Условия хранения, продлевающие его срок, - темное, сухое, прохладное место.
- Нельзя смешивать пероксид водорода с любыми жидкостями, кроме чистой воды, в том числе и с хлорированной водой из-под крана.
- Все вышесказанное применимо не только к Н2О2, но и ко всем содержащим его препаратам.